Si devono avere
delle attenzione particolari
con l’adolescente ?
Assistenza Domiciliare per Bambini malati gravi
Una Guida per i Genitori
pp.46-47
L’adolescenza é un periodo difficile per quasi tutti i bambini. E’ la fase di passaggio dalla dipendenza del bambino all’indipendenza del giovane adulto. Significa assumere un ruolo nuovo e spesso responsabilità molto diverse e difficili. Quasi come se per l’adolescente una malattia gravissima e la morte stessa siano emotivamente più difficili. E’ a questa età che si acquista piena coscienza del carattere definitivo ella morte. Il ragazzo o la ragazza deve affrontare il fatto che la morte impedirà la realizzazione di ogni progetto e aspirazione per il futuro proprio nel momento in cui comincia a godere della sua nuova indipendenza e si affaccia al futuro immaginando la propria vita fuori della casa paterna.
Quando la malattia entra nella fase terminale l’adolescenza ha piena cognizione di quello che significa: nel nostro studio abbiamo visto che tutti i ragazzi di questa età, senza eccezione, parlavano della propria morte imminente (magari preferivano talvolta parlarne con un adulto diverso dai genitori). Dialogare con l’adolescente e permettergli così di esprimere, se lo vuole, tutti i sentimenti che sta vivendo, dai normali problemi dell’adolescenza alla malattia e alla morte, potrà essergli di grande aiuto. Se vostro figlio non riesce a confidarsi con voi, potreste decidere di ricorrere ad altre figure adulte al di fuori della famiglia, per esempio un insegnante, un sacerdote, un parente o uno psicologo.
Nella maggior parte dei casi il processo di maturazione adolescenziale prosegue nonostante la malattia, cosicché tutti quegli atteggiamenti e quei comportamenti che normalmente a questa età portano scompiglio nella vita familiare influenzeranno i modi in cui l’adolescente malato fa fronte alla malattia, ai medici, alla famiglia e a se stesso. Questi ragazzi avevano bisogno di sostegno e comprensione.
Quelli che seguono sono alcuni suggerimenti che possono esservi di aiuto nell’assistere in casa l’adolescente che si avvicina alla morte. La prima decisione da prendere può essere se tuo figlio debba morire in casa o all’ospedale. Quasi tutti gli adolescenti del nostro gruppo volevano fa da soli il più possibile e mantenere la loro indipendenza nelle attività quotidiane - una ragazza si preparò da sé la colazione poche ore prima di morire.
Gli sforzi dell’adolescente per affermare la sua indipendenza e acquistare maturità possono dar luogo a conflitti in famiglia. L’assistenza domiciliare che tende a mantenere un’interazione continua fra i familiari, permette occasioni di elaborare e risolvere quei problemi e quei contrasti. Nella nostra ricerca abbiamo osservato che l’assistenza in casa nella fase terminale aiutava tanto l’adolescente quanto gli altri a comprendersi ed accettare meglio la vicenda, risolvendo vecchi conflitti.
Un altro campo dove l’assistenza in casa deve tener conto della crescente autonomia dell’adolescente é la somministrazione dei farmaci. Di solito a questa età i ragazzi non vogliono sentirsi "drogati" dalle medicine contro il dolore, per non perdere il controllo della situazione. La soluzione preferita consiste in dosi a orari fissi, sufficienti a controllare il dolore col minimo di sonnolenza possibile.
Infine gli adolescenti devono essere preparati ai possibili cambiamenti fisici che avverranno proprio prima della morte sia che questa avvenga a casa o in ospedale. Questa preparazione li aiuterà ad esempio, della possibilità di alterazioni e difficoltà respiratorie, crisi convulsive, emorragie e sintomi di infezione.
Analgesia autoregolata
negli adolescenti
L’analgesia autoregolata (PCA: patient controlled analgesia) é un metodo per la somministrazione di narcotici in cui il paziente può regolare personalmente alcuni aspetti del trattamento. Questa forma di terapia sta avendo una rapida diffusione per il trattamento del dolore postoperatorio in pazienti adulti, 1-10 ma l’esperienza con adolescenti é scarsa. Preoccupazioni teoriche circa l’immaturità dei soggetti e l’uso di sostanze suscettibili di creare assuefazione e dipendenza possono indurre alcuni medici ad evitare l’analgesia autoregolata in questa fascia d’età. In questo articolo si riferisce la nostra esperienza durante il primo anno di introduzione del metodo in un ospedale pediatrico e si formulano le nostre indicazioni per il suo uso con gli adolescenti.
Metodi
Abbiamo utilizzato la pompa PCA Lifecare prodotta dai laboratori Abbott. L’apparecchio consiste in una pompa per infusione in vena che é programmata per somministrare una dose prestabilita di narcotico quando é azionata dal paziente. Collegato alla flebo, é collocato in prossimità del paziente, il quale può azionarlo premendo un pulsante. Ad ogni pressione del pulsante si ha la somministrazione di un piccolo bolo di narcotico, seguita da un periodo di blocco durante il quale l’apparecchio non può essere riattivato: questo dispositivo autobloccante permette al paziente di avvertire gli effetti del narcotico prima di assumerne una seconda dose. E’ programmato anche un tetto cumulativo del dosaggio nell’arco di 4 ore. Dosi singole, durata del periodo di blocco e limite cumulativo nelle 4 ore sono decisi dal medico.
Dato che le esperienze precedenti riguardavano quasi soltanto i pazienti adulti, non avevamo indicazioni precise per stabilire questi valori con adolescenti. Abbiamo scelto inizialmente un bolo piccolo e un dosaggio massimo nelle 4 ore che ci appariva non pericoloso, aggiustando poi il volume delle dosi singole e il tetto cumulativo secondo le necessità dei pazienti dopo che l’apparecchio era entrato in funzione. Le variazioni del dosaggio erano decise dagli anestesisti a seconda della risposta del paziente. Prima di avviare il trattamento autoregolato, i pazienti erano trattati con narcotici nella sala postoperatoria fino ad ottenere un adeguato effetto analgesico. In alternativa, si può somministrare una dose di carico di narcotici mediante l’apparecchio stesso, ma non abbiamo scelto questa via.
Le infermiere registravano il numero di dosi e i milligrammi di morfina usati in ogni intervallo di 4 ore. Ogni 4 ore si accertava il ritmo respiratorio. Alcune infermiere chiedevano ai pazienti di valutare il livello del dolore su una scala da 0 a 10, dove 0 corrisponde ad assenza di dolore e 10 al dolore peggiore possibile. I dati sono stati raccolti retrospettivamente dalle cartelle cliniche. esaminando le cartelle, si sono notati peso, età, tipo di intervento chirurgico, altre patologie e taratura dell’apparecchio per l’autosomministrazione, oltre al consumo di morfina durante ogni turno del personale infermieristico, ritmo respiratorio e - quando erano stati rilevati - i punteggi nella scala del dolore. Sono stati considerati i dati di tutti i 26 pazienti trattati con questo metodo nel primo anno dall’introduzione della PCA nel nostro ospedale. Del gruppo fanno parte due pazienti non chirurgici, uno con fibrosi cistica e forti dolori del torace, l’altro con crisi vasoocclusive da anemia delle cellule falciformi. Il resto dei pazienti ha utilizzato il trattamento in fase postoperatoria. tre pazienti hanno subito due interventi successivi, usando l’analgesia autoregolata, in entrambe i casi, per cui abbiamo raccolto i dati su un totale di 29 trattamenti. Sette dei pazienti chirurgici presentavano patologie concomitanti: mielomeningocele, blocco renale con nefrectomia in preparazione per un trapianto di rene, complessa cardiopatia congenita, distrofia muscolare di Duchenne (3 casi), sindrome di Job con associata malattia polmonare restrittiva e ostruttiva, malformazione del setto atriale e tetralogia di Fallot (operato in precedenza). La gamma d’età era dai 12 ai 20 anni, con età media di 16.0. Nel gruppo c’erano 15 maschi e 11 femmine. Pur mancando dati sul livello sociale o il gruppo etnico, la composizione del campione rifletteva la popolazione complessiva del nostro ospedale, prevalentemente bianca e di classe media, con piccole percentuali di neri, asiatici e poveri dei ghetti urbani.
La selezione dei pazienti per la PCA é stata operata in base alla previsione di uso di narcotici per via parenterale e al giudizio dei medici (chirurgo e anestesia) circa la loro capacità di capire il procedimento. I dati relativi ai 24 pazienti chirurgici sono riportati nella tabella 1. Dopo l’aggiustamento della dose singola e del dosaggio massimo nelle 4 ore in base alle necessità dei pazienti, la dose media é risultata 0,0017 mg/kg e il limite medio effettivo nell’arco delle 4 ore 0,257 mg/kg. L’intervallo di blocco era di 10 minuti per tutti.
Tab.1 - Descrizione dei pazienti postoperati trattati con PCA.
|
n.paz. |
Peso (kg) |
Operazione |
Altre condizioni mediche |
Età |
|
|
1 |
36 |
Fusione spinale anteriore |
Mielomeningocele T12 |
13 |
|
|
1 |
35 |
Fusione spinale posteriore |
Mielomeningocele T12 |
13 |
|
|
2 |
55 |
Riparazione di pectus excavatum excavatum |
15 |
||
|
3 |
48 |
Nefrectomia |
Insufficienza renale |
19 |
|
|
4 |
50 |
Revisione dei bastoncelli di Harrington |
Ventricolo singolo.Shunt di Balock Taussing |
17 |
|
|
5 |
55 |
Fusione spinale posteriore |
Distrofia muscolare di Duchenne |
14 |
|
|
6 |
75 |
Osteotomia tibiale più trapianto osseo |
17 |
||
|
7 |
44 |
Fusione spinale anteriore |
14 |
||
|
8 |
62 |
Riparazione di pectus excavatum |
15 |
||
|
9 |
83 |
Fusione spinale anteriore |
16 |
||
|
10 |
44 |
Osteotomia tibiale |
18 |
||
|
11 |
60 |
Osteotomia acetabolare |
16 |
||
|
12 |
41 |
Fusione spinale posteriore |
Sindrome di Giobbe con malattia restrittiva ed ostruttiva polmonare |
14 |
|
|
3 |
58 |
Fusione spinale posteriore |
17 |
||
|
14 |
43 |
Fusione spinale posteriore |
Distrofia muscolare di Duchenne |
15 |
|
|
15 |
70 |
Fusione spinale posteriore |
17 |
||
|
n.paz. |
Peso (kg) |
Operazione |
Altre condizioni mediche |
Età |
|
|
16 |
63 |
Fusione spinale posteriore |
Post-riparazione di ASD e TEF |
12 |
|
|
17 |
58 |
Fusione spinale posteriore |
Distrofia muscolare |
16 |
|
|
18 |
51 |
Riparazione di petto carenato |
15 |
||
|
19 |
44 |
Osteotomia sagittale |
15 |
||
|
20 |
53 |
Rimozione di cisti ovarica |
17 |
||
|
21 |
54 |
Riparazione di palato alveolare, trapianto |
17 |
||
|
22 |
62 |
Osteotomia di Leforte |
19 |
||
|
23 |
40 |
Fusione spinale posteriore |
16 |
||
|
23 |
40 |
Fusione spinale anteriore |
16 |
||
|
24 |
70 |
Fusione spinale anteriore |
17 |
||
|
24 |
70 |
Fusione spinale posteriore |
17 |
Risultati
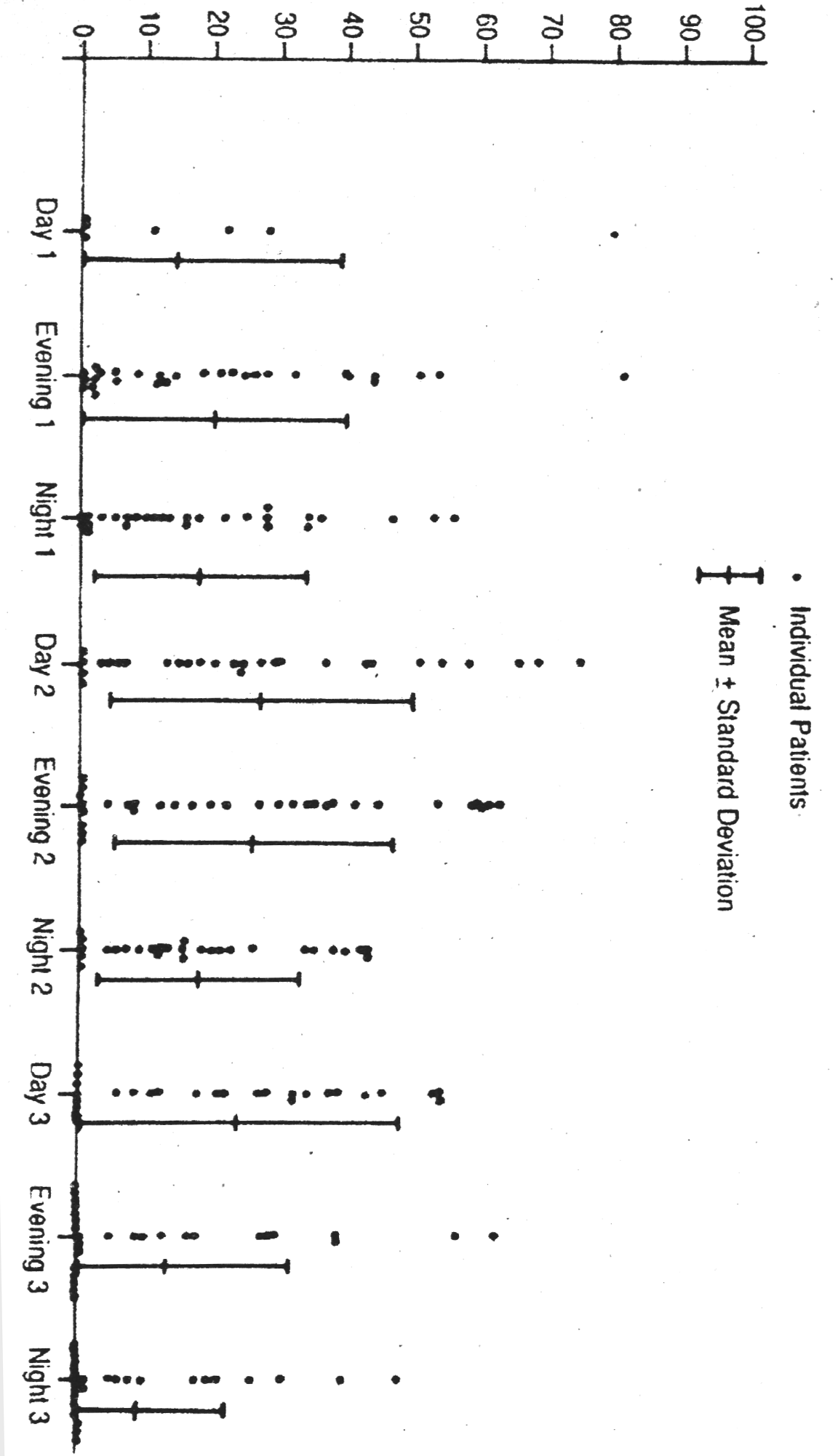
Media deviazione standard e gamma totale del consumo orario di morfina per ciascun turno ospedaliero di 8 ore nei primi 4 giorni di trattamento sono riportati nella tab.2. Alla fig.1 é visibile il grafico dei consumi individuali e medi. (Ai fini del confronto, una dose di morfina di 0,05 mg/kg somministrata in vena ogni 2,5 ore darebbe un consumo orario di 0,02 mg/kg/h). Il dosaggio orario di morfina in autosomministrazione é simile ai tipici dosaggi postoperatori, ma la variabilità registrata in regime di PCA é ampia, con una gamma totale che nei nostri pazienti arriva a variazioni di 4-8 volte.
|
1 |
2 |
3 |
4 |
|||||||||
|
giorno |
serale |
notte |
giorno |
serale |
notte |
giorno |
serale |
notte |
giorno |
serale |
notte |
|
|
Numero |
5 |
25 |
26 |
24 |
22 |
23 |
20 |
13 |
13 |
8 |
3 |
2 |
|
Consumo medio (mg/kg/h) |
0,03 |
0,023 |
0,021 |
0,03 |
0,033 |
0,022 |
0,029 |
0,027 |
0,018 |
0,032 |
0,014 |
0,012 |
|
D.S. |
0,03 |
0,02 |
0,015 |
0,02 |
0,019 |
0,014 |
0,016 |
0,018 |
0,015 |
0,02 |
0,009 |
0,002 |
|
Minimo |
0,01 |
0,002 |
0,002 |
0 |
0,004 |
0,004 |
0,006 |
0,005 |
0,001 |
0,005 |
0,006 |
0,01 |
|
Massimo |
0,08 |
0,081 |
0,056 |
0,08 |
0,063 |
0,044 |
0,054 |
0,063 |
0,048 |
0,067 |
0,024 |
0,013 |
Tab.2 - Consumo orario di morfina per ogni turno infermieristico

Fig.1 - Consumo orario di morfina per i singoli pazienti. Le sbarrette verticali indicano la media e la deviazione standard del gruppo. I periodi corrispondono ai turni infermieristici.
Per accertare eventuali differenze legate all’età e al sesso, abbiamo confrontato il consumo orario dei pazienti di almeno 17 anni e di non oltre 15 e quello dei maschi e femmine, utilizzando i dati del turno diurno in seconda giornata. I valori sono riportati alla tabella 3. Non risultano differenze significative. Le deviazioni standard sono alte, indicando la notevole variabilità nell’uso di morfina.
|
Età<=15 |
Età>=17 |
Maschi |
Femmine |
|
|
Media |
0,024 |
0,026 |
0,033 |
0,020 |
|
D.S. |
0,014 |
0,026 |
0,026 |
0,017 |
I dati sono in mg/kg/h. Nessuna differenza significativa
Tab.3 - Media e D.S. del consumo orario di morfina nel turno infermieristico diurno.
I punteggi nella scala del dolore rilevati dalla infermiere sono indicati nella Tab.4. I valori erano compresi nella fascia intermedia della scala, usando un livello di dolore medio-lieve. In un solo caso si é ottenuta da un paziente una valutazione di 0 (assenza di dolore).
Non é mai stato rilevato un ritmo respiratorio inferiore a 10 al minuto, con una media intorno a 20 in tutti i periodi considerati.
|
1 |
2 |
3 |
||||||
|
serale |
notturno |
diurno |
serale |
notturno |
diurno |
serale |
notturno |
|
|
Punteggio medio (0-10) |
4,3 |
7 |
4,8 |
4,5 |
4,7 |
4,3 |
3 |
3 |
|
Numero |
4 |
3 |
5 |
4 |
7 |
3 |
2 |
2 |
Il dolore é valutato dal paziente su una scala da 1 a 10, dove 10 corrisponde al dolore più intenso.
Tab.4 - Punteggi del dolore in un gruppo di adolescenti in regime di PCA.
Nessun paziente ha chiesto di passare dall’autosomministrazione alla terapia antidolore tradizionale. La maggior parte dei pazienti si dichiarava soddisfatta del livello di analgesia così ottenuto per esprimeva il desiderio di poter utilizzare lo stesso metodo in futuro. Molti commentavano favorevolmente la possibilità di controllare la terapia antidolore secondo le proprie necessità anziché in base agli orari prescritti dal medico, alla routine ospedaliera o alla disposizione dell’infermiera. Alcuni avevano avuto precedenti esperienze chirurgiche con terapia analgesica convenzionale e tutti loro preferivano l’autosomministrazione. In nessun caso abbiamo avuto l’impressione che i pazienti usassero la morfina in vista dei suoi effetti euforici.
Un paziente in trattamento per crisi di anemia delle cellule falciformi, che a 18 anni era già stato ricoverato all’ospedale ripetutamente per lo stesso problema, preferiva iniezioni intramuscolari di morfina.
In un caso era il genitore ad azionare l’apparecchio per il paziente: si trattava di una circostanza molto particolare, dovuta ad una distrofia muscolare così grave da impedire al paziente di premere egli stesso il pulsante.
Il personale infermieristico, inizialmente preoccupato all’idea che i pazienti si somministrassero da soli la terapia antidolore, dopo le prime esperienze si é mostrato entusiasta del nuovo metodo.
Discussione
L’analgesia autoregolata appare un mezzo efficace per controllare il dolore postoperatorio negli adolescenti. La nostra esperienza é simile a quanto già osservato con pazienti adulti.1-10 Già adolescenti sono capaci di usare responsabilmente questo metodo, non abusano del narcotico e nella nostra casistica, non hanno presentato segni clinici di depressione respiratoria (anche se non abbiamo rilevato indici come gas ematici o curve di risposta della CO2).
Può darsi che la somministrazione di narcotici deprima la curva di risposta della CO2 , ma d’altro canto é anche possibile che il sollievo del dolore permetta una respirazione più profonda, col risultato di migliorare la curva della CO2. Una valutazione del trattamento di analgesia autoregolata con pazienti adulti non ha messo in evidenza alcun aumento del pCO2 a riposo 8 e in un’altra ricerca con 56 pazienti solo due hanno presentato aumento del pCO2 attribuito dagli autori ad ipovolemia. 11 Ulteriori ricerche saranno necessarie per accertare gli effetti dell’intervento chirurgico e della PCA sulla curva di risposta della CO2 negli adolescenti.
Il consumo di morfina, benché assai costante nel tempo per ogni singolo paziente, ha presentato un’ampia variabilità soggettiva, con differenze massime fino a 4-8 volte. dati simili sono stati rilevati negli adulti. 1,4,6,8,10,12,13 Tale variabilità rispecchia probabilmente grandi differenze individuali nella risposta al dolore, che possono derivare da tre cause: differenze farmacocinetiche, variazioni nei livelli dell’endorfina e della Sostanza P 7 e differenze psicologiche 14-16.
L’adolescenza é il periodo in cui si sviluppa un’esistenza autonoma, separata dai genitori e quindi, nella maggior parte dei ragazzi di quell’età c’é l’aspirazione all’autonomia. Per questa ragione appare particolarmente opportuno lasciare agli adolescenti un certo controllo sulla terapia antidolore.
Il fatto che i pazienti non assumano dosaggi tali da produrre analgesia completa, ma mantengano un certo livello di dolore é un’osservazione interessante, già fatta anche con adulti in regime di analgesia autoregolata. 5,8 Il fenomeno non é dovuto all’impossibilità di ottenere quantità maggiori di narcotico. Al contrario, nei casi in cui il paziente raggiunge il limite programmato di dosaggio nelle 4 ore, la nostra prassi, in assenza si segni di sedazione eccessiva o di depressione respiratoria, era di aumentare il limite; non si é quindi verificato nessun caso in cui il paziente non potesse, in presenza di dolore, assumere altro narcotico a causa dei limiti imposti dalla macchina. A quanto sembra, adolescenti adulti si mantengono a un certo livello d’intensità del dolore, forse regolando l’azione analgesica in funzione di altri effetti collaterali, come nausea, vomito o sedazione. Un’altra spiegazione possibile é che i pazienti siano preparati a dover sopportare il dolore in fase postoperatoria: non aspettandosi di essere esenti dal dolore, non cercano di lberarsene totalmente con il narcotico, pur avendolo a disposizione.
La PCA é un metodo efficace per controllare il dolore negli adolescenti. Ha il vantaggio di permettere al paziente di regolare la terapia secondo il suo fabbisogno personale, adattandosi all’ampia variabilità soggettiva nella richiesta di antidolorifici nella fase postoperatoria. Con un’attenta selezione non sembra che il metodo debba essere negato a pazienti con patologie croniche come la distrofia muscolare, ma a conferma di questa conclusione saranno necessari altri dati.
Nell’uso con adolescenti, raccomandiamo di iniziare la PCA con dosi singole di 0,015 mg/kg di morfina e con un limite massimo di 0,25 mg/kg nelle 4 ore, dopo una prima dose di carico regolata in modo da ottenere un effetto analgesico adeguato senza depressione respiratoria. Alcuni dettagli tecnici sono importanti quando si introduce questo metodo in un ospedale che non ne ha esperienze precedenti. Primo é necessario un sistema per registrare esattamente le dosi di narcotico. Con la pompa Abbott, questi dati si ottengono ogni 4 ore, quando si azzera la macchina e devono essere inseriti nella cartella clinica, in tal modo si garantisce una valutazione precisa dei dosaggi complessivi. Secondo, si deve tener presente che la dose di partenza e il limite massimo del dosaggio nelle 4 ore non sono altro che i punti di partenza congetturali, da modificare eventualmente a secondo delle necessità del paziente. Quando la dose prevista non produce alcun sollievo del dolore, é indicato un aumento di circa il 50%. Se la dose singola é adeguata, ma il paziente consuma il dosaggio massimo previsto prima del termine di 4 ore, é il caso di considerare l’opportunità di aumentare il tetto massimo: se il paziente denuncia dolore, richiede altro narcotico, non é sedata e non presenta segni clinici di depressione respiratoria, a nostro avviso é opportuno aumentare il limite del dosaggio massimo nelle 4 ore. Terzo, per decidere cambiamenti nella regolazione dell’apparecchio e per affrontare eventuali problemi, é necessari al visita quotidiana e la reperibilità continua di un medico che abbia familiarità col metodo.
Generalmente vietiamo ai genitori di azionare l’apparecchio in luogo del paziente, per evitare problemi di disaccordo fra paziente e genitore ed impedire che questi somministri narcotico in eccesso per assicurare il benessere del figlio. Una delle garanzie implicite nell’autosomministrazione di analgesici é che fra i primi segni di dosaggio eccessivo c’é la sedazione, e un paziente sedato e soporoso non può premere il pulsante per ottenere un’altra dose: questo fattore di sicurezza sarebbe annullato se i genitori (o il personale infermieristico) fossero autorizzato ad azionare la macchina in luogo del paziente.
Riassumendo, in un gruppo di adolescenti postoperati, la PCA ha assicurato un’analgesia adeguata. Il consumo di narcotico é risultato paragonabile a quello in regime convenzionale di somministrazione parenterale, ma si é registrata un’ampia variabilità soggettiva. L’analgesia autoregolata é un mezzo soddisfacente per il trattamento del dolore postoperatorio negli adolescenti.
Sommario
L’analgesia autoregolata (PCA) é un metodo di somministrazione di narcotici in cui il paziente aziona un apparecchio che eroga piccoli boli della sostanza. Nel primo anno dall’introduzione del metodo nel nostro ospedale, l’abbiamo sperimentato con 26 pazienti. Suggeriamo dosi singole di 0,015 mg/kg e un dosaggio massimo di 0,25 mg/kg/4h, con 10 minuti di blocco dopo ogni singola erogazione. I pazienti hanno usato approssimativamente quantità equivalenti ai dosaggi standard di narcotico per via perenterale, ma con una larga variabilità individuale. Non si sono notati segni clinici di depressione respiratoria e i pazienti non hanno regolato i dosaggi fino ad analgesia completa. La PCA é un metodo efficace per il controllo del dolore negli adolescenti.
BIBLIOGRAFIA
1. Atwell JR, Flanigan RC, Bennett RL, et al. "The efficacy of patient-controlled analgesia in patientss recovering from Rank incision" J.Urol.1984, 132:710-3
2. Bennett R, Batenhorst R, Graves D, et al. "Morphine titration in postoperative laparotomy patients using patient-controlled analgesia" Curr.Therapeutic Res. 1982, 32:45-52
3. Keeri Szanto M, Heaman S. "Postoperative demand analgesia" Surg. Gyn.Obstet 1972, 134:647-51
4. Sechzer P "Studies in pain with the analgesic demand system" Anesth Analg 1971, 50:1-10
5. Slattery PJ, Harmer M, Rosen M, et al. " An open comparison between routine and self-administered postoperative pain relief" Ann Roy Coll Surg Eng 1983, 65:18-19
6. Tamsen A, Hartvig P, Fagerlund C et al. "Patient-controlled analgesic therapy" part.II: Individual Analgesic demandand analgesic plasma concentrations of pethidine in postoperative pain. Clin. Pharmacokinet 1982, 7:164-75.
7. Tamsen A, Sakurada T, Wahlström A et al. "Postoperative demand for analgesic relation to individual levels of endorphine and substance P in cerebrospinal fluid" Pain 1982, 13:171-83
8. White WD, Pearce DJ, Norman J "Postoperative analgesia: acomparison of intravenous on-demand fentanyl with epidural bupivacaine" Br Med J 1979, 2:166-7
9. Forrest WH, Smethurst PWR, Kienitz ME "Self Administration of intravenous analgesic" Anesthesiology, 1970, 33:363-5
10. Hull CJ, Sibbad A "Control of postoperative pain by interactive demand analgesia "Br J Aneth 1981, 53:385-91
11. tamsen A, HArvig P, Fagerlund C et al. "Patient-controlled analgesic therapy: Clinical experience" Acta Anaesth Scand 1982, 74: (suppl) 157-60
12. Bennett RL, Batenhorst RL, Bivins BA et al. "Patienti-controlled analgesia. A new concept of poetoperative pain relief" Ann Surg 1982, 195:700-5
13. Tamsen A, Harvig P, Dahlström B et al. "PAtinet controlled analgesic therapy in the early postoperative period" Acta Anaesth AScand 1979, 23:462-70
14. Lim AT, Edis G, Kranz H et al. "Postoperative pain control: contribution of psychological factors and transcutaneous electrical stimulation" Pain 1983, 17:179-88
15. Scott Le, Clum GA, Peopies JB "Preoperative predictors of postoperative pain" Pain 1983, 15:283-93
16. Wilson JF, Bennett RL "Coping styles medication use, and pain score in patients using patient controlled analgesia for postoperative pain" Anesthesiology 1984, 61:A193.
La PCA nell’adolescente
Nell’età dell’adolescenza, come nel bambino più piccolo, l’intervento chirurgico costituisce, per il paziente come per i familiari, una esperienza stressante. L’uso dell’analgesia controllata dallo stesso paziente (PCA) é una tecnica largamente affermata nell’adulto che si é recentemente estesa anche al bambino. Il concetto é estremamente facile e si riassume nel semplice "/// premi il bottone se vuoi eliminare il dolore". Ogni bambino in grado di capire questa semplice frase é un possibile soggetto per la PCA. E’ evidente che, tranne nei casi particolari, ogni adolescente é in grado di capire bene questo concetto. Ciò é importante: nessun altro infatti, tranne il paziente, deve essere autorizzato a premere il bottone.
La decisione di applicare nel postoperatorio la PCA deve essere valutata e presa dall’anestesista prima dell’intervento chirurgico. La tecnica deve essere spiegata all’adolescente ed ai suoi familiari. Cercare di dare spiegazioni anche semplici in un paziente dolorante o sotto effetto di analgesici, é illusorio. Il ragazzo deve sapere che solo lui può azionare la pompa della PCA. E’ inoltre opportuno che sia fornita una ampia a dettagliata spiegazione di come la tecnica funziona. Tra l’altro, il poter controllare il dolore in un periodo (il postoperatorio) in cui quasi tutto si svolge fuori del controllo del bambino come dell’adolescente, ha rilevanti effetti benefici sul piano psicologico.
Gli adolescenti pongono tuttavia problemi particolari, legati alle diverse fasi di sviluppo psichico (precoce, media e tardiva) che essi attraversano. Esse vanno conosciute e considerate. Per esempio, il problema dell’immagine corporea é importante: l’adolescente spende moltissimo tempo nella valutazione della propria immagine, confrontandola con quella degli altri. Un intervento chirurgico che leda in qualche misura questa immagine, può essere fonte di angoscia che si riflette inevitabilmente sulla elaborazione della percezione dolorosa. Da tempo quindi deve essere dedicato per informare circa l’evento chirurgico (possibili esiti cicatriziali). Occorre ricordare che la depressione psichica é fenomeno non infrequente in età adolescenziale. Deve essere riconosciuta mediante un’attenta anamnesi centrata su eventuali anomalie del comportamento , sul rendimento scolastico, sull’esistenza o meno di problemi psicosomatici. Anche una anamnesi di frequente ricorso al medico deve far nascere il sospetto che alla base vi sia una possibile sindrome depressiva. E’ evidente che una depressione può determinare risultati deludenti e vanificare, se non riconosciuta, i tentativi per una corretta terapia analgesica.
La tossicomania e la tossicodipendenza sono fenomeni che colpiscono questa età. Anche il fumo e l’alcool debbono essere considerati perché non di raro riscontro. Occorre ancora indagare sui problemi del comportamento su eventuali segni di lesione o su episodi di overdose.
A differenza del bambino piccolo, sempre accompagnato dai genitori, la maggior parte delle notizie anamnesiche vanno raccolte con l’adolescente da solo nell’ambulatorio. Tuttavia in seguito é bene sempre confrontare con i genitori le impressioni ricavate.
La decisione di adottare la PCA modifica la condotta anestesiologica intraoperatoria. Ad esempio, si può decidere di ricorrere ai morfinici, nel periodo preoperatorio, anziché alle tecniche di analgesia peridurale. Lasciare un catetere in peridurale nel postoperatorio ha senso solo se si adottano altre tecniche analgesiche, quali la analgesia peridurale continua od a boli, oppure la EPCA, cioé l’analgesia epidurale controllata.
Sul mercato, disegnati per gli adulti, sono disponibili numerosi modelli per la PCA che possono tranquillamente essere adoperati anche negli adolescenti. Se vi sono problemi specifici, per esempio, ustioni alle mani, l’interruttore deve poter essere altrimenti azionato, ad esempio con il piede.
L’interruttore non possiede speciali requisiti. Dovrebbe però non potersi confondere con altri interruttori presenti attorno al letto del paziente (per esempio quello della luce io per chiamare l’infermiera).
E’ importante che, nel deflussore della linea venosa della PVA, sia prevista la valvola antireflusso, se si intendono somministrare contemporaneamente anche liquidi od altri farmaci. Questa valvola previene il possibile accumulo di morfina nel deflussore se dovesse verificarsi l’inconveniente del blocco della cannula.
La maggior parte delle pompe PCA posseggono quattro funzioni per aggiustare:
1. la loading dose
2. la dose bolo (cioé la dose che viene somministrata quando il paziente attiva la pompa)
3. un intervallo "lockout", entro il quale, anche se azionata, la pompa non risponde; e
4. un controllo della massima dose oraria.
Sempre meno usata é la infusione basale continua ("background", tranne forse in casi particolari, ad esempio se si desidera garantire il riposo notturno, non costringendo il paziente ad intervenire sul bottone per azionare la pompa e fugare il dolore. Ricerche accurate hanno però dimostrato che non vi sono reali vantaggi ad inserire questa perfusione continua. La tecnica PCA é sicura perché autolimitante. Infatti, se la dose (in genere morfina) é eccessiva, il paziente si assopisce e quindi automaticamente cessa di somministrarsi ulteriori dosi. L’infusione basale continua di supporto potrebbe allora, portando verso livelli ematici tossici, risultare addirittura pericolosa.
La "loading dose" non é necessaria quando si sia fatto uso di un blocco regionale. I boli a domanda in questo caso inizieranno quando il blocco recede ed il dolore compare. In ogni caso il paziente deve essere dismesso dalla sala operatoria in analgesia.
|
Bolo iniziale |
Dose PCA |
Infusione di base |
Massimo orario |
Lockout |
|
0,02 mg/kg |
0,01-0,025 mg/hr |
10-25µk/kg/hr |
0,05-0,10 mg/kg/hr |
ogni 6-12 minuti |
|
incrementi ogni 10 min. fino al pieno conforto |
iniziare subito dopo il bolo |
rango inferiore all’inizio; poi incrementare se necessario |
Gli effetti collaterali sono quelli che possono comunemente intervenire con la somministrazione di oppiacei; eccessiva sedazione, depressione respiratoria, nausea, prurito, disforia e costipazione.
La metoclopramide (0,10-0,15 mg/kgEV), o meglio ancora l’ondansetron (0,25 mg/hg), possono essere adoperati come antiemetici.
recentemente sono stati descritti buoni risultati con il Ketolorac. Si tratta di un agente non steroideo, inibitore delle ciclo-ossigenasi, con un potente effetto analgesico ed un modesto effetto anti-infiammatorio. La somministrazione in bolo singolo avrebbe addirittura effetti analgesici superiori a quelli della morfina, della meperidina o della pentazocina, e con fenomeni collaterali meno rilevanti. Sfortunatamente sono stati segnalati casi di grave insufficienza renale dopo dose singola di Ketolorac i.m., per cui é prudente evitare di somministrarlo in casi di screzio renale.
Comunque nella nostra esperienza sono stati ottenuti buoni risultati (soprattutto nelle ustioni) adottando il seguente protocollo.
|
Bolo iniziale |
Dose PCA |
Infusione basale |
Massimo orario |
Lockout |
|
|
0,6 mg/kg |
0,04 mg/kg |
0,05 mg/kg/hr |
0,3 mg/kg |
ogni 15 minuti |
Il vantaggio principale del Ketolorac rispetto agli oppiacei é quello di non provocare alcuna depressione respiratoria e pertanto può essere adoperato anche in ambienti ove la sorveglianza post-operatoria é ridotta, o non si disponga di strumenti quali ad esempio il polso-ossimetro. recentemente é stato segnalato in bambini ed adolescenti l’uso epidurale di morfina regolato attraverso la PCA. Le esperienze al riguardo dono ancora scarse, e poco può quindi essere detto al riguardo.
In conclusione la PCA con morfina o ketolorac é una tecnica di facile esecuzione, molto efficiente ed affidabile. L’uso del ketolorac é raccomandabile quando non si disponga di una terapia intensiva post-operatoria.
BIBLIOGRAFIA
1. Neilstein LS "Adolescent health care: A pratical guide" Baltimora, Urban and Shwarzenberg, 1984, pp.35-40
2. Brown R and Broadman IM "Patient controlled analgesia (PCA) for post-operative pain control in adolescents "Anesthesia and Analgesia, 1987, 66:S22
3. Berde CB, Yee JD, Lehn DM, Moore LJ and Sethna NF "Patient controlled analgesia in children and adolescents: a randomized comparison with intramuscular morphine" Anesthesiology 1990, 73:A1102
4. McKenzie R, Rudy T, Tantisira B "Comparison of PCA alone and PCA with continuous infusion on pain relief and quality of sleep" Anesthesiology, 1990, 73:A787
5. Bean JD and Hunt R "Analgesic efficacy of ketolorac in post-operative pediatric patients" Anesthesia and Analgesia 1992, 74:S20
6. Bellamy CD, McDonnel FJ, Kolclough GW et al. "Epidural Infusion ? PCA for pain control in pediatric patients" Anesthesia and Analgesia, 1990, 70:S19.
Patrick J McGrath Ph.D e altri
Efficacia ed efficienza
di un trattamento autosomministrato
per l’emicrania dell’adolescenza
Sommario
L’emicrania é frequente nell’adolescenza. Benché per molti pazienti sia adeguato il trattamento palliativo con analgesici, un sottogruppo importante richiede un intervento preventivo.
Il trattamento medico di adolescenti con gravi cefalee ricorrenti é spesso problematico. I trattamenti farmacologici preventivi sono accettati malvolentieri dai ragazzi e dai genitori a causa di timori sull’uso di farmaci e droghe. Inoltre il propanololo, il farmaco più usato nel trattamento preventivo degli adulti, spesso si dimostra inefficace. Gli interventi psicologici sono efficaci ma costosi e spesso inaccessibili.
E’ stata condotta una sperimentazione controllata su un campione casuale per valutare l’efficacia e l’efficienza di un trattamento da eseguire prevalentemente in autosomministrazione, con un ottimo rapporto costi/benefici.
Per informazioni scrivere a:
Professor Patrick J. McGrath
Dept. of Psychology - Dalhouse University
Halifax
Nova Scotia
B3HJ1 CANADA
Un campione di 87 adolescenti (63 ragazze e 24 ragazzi) di età compresa fra 11 e 18 anni é stato diviso in 3 gruppi per ricevere: un trattamento somministrato in ambulatorio, o un trattamento di controllo.
Il trattamento autosomministrato e il trattamento in ambulatorio sono risultati ugualmente efficaci e superiori al trattamento di controllo, ma il trattamento autosomministrato si é dimostrato sostanzialmente più efficiente rispetto alla somministrazione ambulatoriale. entrambi i trattamenti attivi mantenevano la loro efficacia al controllo eseguito a distanza di un anno.
Introduzione
L’emicrania dell’adolescenza é un disturbo comune, con un’incidenza dal 6.4 al 15,1% nelle ragazze e dal 4 al 8.1% nei maschi (Billie, 1962: Sillanpaa, 1983). I trattamenti palliativi, come l’acetaminofene, sono di solito efficaci per alleviare cefalee relativamente sporadiche, ma diventano insufficienti quando gli attacchi sono più frequenti e intensi: in quel caso si richiede un intervento profilattico.
Le strategie più comuni per la prevenzione dell’emicrania sono il trattamento farmacologico e psicologico. Il farmaco preferito con gli adulti é il propanololo, ma studi recenti hanno dimostrato che é inefficace o controindicato con gli adolescenti (Forsyte e Coll., 1984; Ilness e Coll., 1987). Gli inibitori del canale del calcio sembrano piuttosto promettenti (Sorge e Marano, 1985) ma non sono ancora generalmente accettati per le emicranie dell’adolescenza. I trattamenti psicologici per il controllo dello stress si sono rivelati efficaci (Richter e Coll., 1986; Olness e Coll., 1987) e sono spesso preferiti, data la riluttanza dei pazienti e dei genitori alla somministrazione quotidiana di farmaci profilattici. Per lo più questi trattamenti si basano sulla riduzione dello stress mediante il rilassamento, l’ipnosi e altre strategie comportamentali e cognitive (Richter e Coll., 1986; Lascelles e Coll. 1990).
Un grosso ostacolo alla diffusione dei trattamenti psicologici é rappresentato dai costi e dalla scarsa accessibilità. Di norma un intervento del genere comporta dalle 1é alle 20 ore di trattamento specialistico, con costi variabili fra i $300 e i $2.000, secondo il numero di sedute, la zona di residenza e il livello di preparazione degli operatori.
Scopo di questa ricerca era valutare un programma di trattamento autogestito per gli adolescenti con l’emicrania. Il programma imperniato su strategie cognitive e comportamentali di rilassamento e controllo dello stress, consisteva in degli esercizi da eseguire a domicilio per 8 settimane, con intervento minimo da parte dei terapisti. Questo trattamento autosomministrato era messo a confronto con una versione dello stesso programma somministrato da un terapista per la stessa durata di 8 settimane e con un’adeguata situazione di controllo.
Metodo
* Soggetti
Il campione comprendeva 87 adolescenti (63 ragazze, 24 ragazzi) di età compresa fra 11 e 18 anni. Prima del controllo a 3 mesi sono andati perduti 14 soggetti. Di questi, 6 appartenevano a ciascuno dei due gruppi di trattamento e 2 al gruppo di controllo. Sono rimasti così 23 soggetti nel gruppo di trattamento autosomministrato e 26 nel gruppo di controllo. La distribuzione di ragazzi e ragazze nei tre gruppi era uniforme e non c’erano significative differenze d’età.
* Procedura
I pazienti erano segnalati dal pediatra o dal medico di famiglia al centro cefalee dell’ospedale pediatrico dello Eastern Ontario. Ciascuno di loro é stato esaminato inizialmente da un nuropsichiatra infantile per confermare la diagnosi di emicrania. I criteri diagnostici prevedevano almeno 3 mesi di cefalee parossistiche intermittenti, più due dei seguenti criteri: precedenti familiari di emicrania; scotoma o fenomeni affini; dolore pulsante; nausea o vomito. Inoltre per essere ammessi alla sperimentazione i soggetti dovevano rientrare nella fascia d’età 11-18 anni, parlare e leggere inglese o francese, non aver fatto trattamento farmacologico preventivo negli ultimi 2 mesi, non presentare problemi neurologici né grossi problemi medici o psicologici. Inoltre, le cefalee non dovevano avere evidenti cause alimentari o allergiche e la frequenza degli attacchi doveva essere superiore a 2 volte al mese. Infine era indispensabile il consenso del paziente e di un genitore alla sperimentazione clinica.
I partecipanti hanno tenuto inizialmente 4 settimane di diario, registrando 4 volte al giorno presenza eventuale e intensità della cefalea su una scala di 6 punti, per stabilire il livello base. Abbiamo già dimostrato la validità di queste misure per l’emicrania nell’adolescenza (Richardson e Coll., 1983).
I riferimenti descrittivi per la valutazione d’intensità sono riportati alla Tab.1.
Valutazione numerica dell’intensità delle cefalee
|
0 |
Nessun mal di testa |
|
1 |
Mal di testa: me ne rendo conto solo se ci faccio attenzione |
|
2 |
Mal di testa: ma posso ignorarlo a volte |
|
3 |
Mal di testa: non posso ignorarlo ma posso fare le mie attività consuete |
|
4 |
Mal di testa: mi é difficile concentrarmi, posso fare solo attività facili |
|
5 |
Mal di testa: così forte che non posso fare niente |
Tab.1 - Valutazione numerica dell’intensità delle cefalee
Al termine delle 4 settimane i soggetti sono stati distribuiti in fasce omogenee per sesso e gravità delle cefalee e assegnati a caso a uno dei tre trattamenti di 8 settimane: programma autosomministrato, programma ambulatoriale e programma di controllo.
Il programma di trattamento autogestito consisteva in un manuale di 8 capitoli con audiocassette (McGrath e Coll., 1990a). Ogni settimana veniva assegnato un capitolo da studiare leggendo il manuale e/o ascoltando le istruzioni registrate. Ogni capitolo presentava diverse strategie antistress. I soggetti del gruppo sperimentale (autosomministrazione) avevano un incontro iniziale col terapeuta, che li contattava in seguito telefonicamente ogni settimana per rispondere ad eventuali domande e discutere dei compiti assegnati per posta - compilazione del diario, esecuzione di un esercizio e compilazione di un questionario di verifica del capitolo. Il programma per il gruppo di trattamento ambulatoriale era identico, salvo il fatto che il manuale, i nastri e le telefonate mensili erano rimpiazzati da sedute individuali con un terapeuta qualificato. Il protocollo di trattamento é illustrato sommariamente alla Tab.2.
SOMMARIO DEL TRATTAMENTO
|
Settimana 1 |
Criteri generali e spiegazione degli esercizi |
|
|
Settimana 2 |
Ristrutturazione cognitiva |
|
|
Settimana 3 |
Esame delle credenze irrealistiche e rilassamento senza tensione |
|
|
Settimana 4 |
Strategie di distrazione |
|
|
Settimana 5 |
Visualizzazione, ripasso comportamentale, attività mentale, rilassamento con visualizzazione |
|
|
Settimana 6 |
Affermazione di sé |
|
|
Settimana 7 |
Soluzione di problemi |
|
|
Settimana 8 |
Sommario delle strategie antistress. |
|
Tab.2 - Sommario del trattamento
Ai soggetti del gruppo di controllo veniva distribuita una lista degli stimoli più comuni che possono scatenare l’emicrania, come alimenti diversi, troppo sole, sforzi eccessivi. In una seduta iniziale il terapeuta li invitava ad individuare gli stimoli responsabili delle loro cefalee e ad evitarli in seguito. Venivano inoltre addestrati a usare una tecnica di "brainstorming" (=assalto delle idee) per affrontare le situazioni stressanti.
Il terapeuta poi telefonava settimanalmente per seguire i loro progressi.
Il gruppo di controllo era impostato come un plausibile trattamento-placebo che prevedeva una quantità di contatti col terapeuta equivalente a quella del gruppo sperimentale.
Terminato il trattamento, tutti i soggetti tenevano il diario delle cefalee per altre 4 settimane, in vista della prima visita di controllo a un mese dalla fine del programma. Per i soggetti del gruppo sperimentale e del gruppo di trattamento ambulatoriale si é proceduto ad altre due visite di controllo, a 3 mesi e un anno di distanza, entrambe precedute dalla compilazione di 4 settimane di diario. Ai soggetti del gruppo di controllo, invece, in occasione della prima visita di controllo si proponeva un altro trattamento.
Risultati
La principale variabile dipendente era l’indice totale di cefalea, ottenuto sommando i valori delle 112 valutazioni numeriche eseguite in ciascun periodo di 4 settimane. Usando l’analisi della varianza per misure ripetute, gli indici totali iniziali sono stati confrontati a quelli rilevati al primo controllo (1 mese) per l gruppo sperimentale (159), ambulatoriale (159) e di controllo (129). Emergeva un effetto significativo gruppo x tempo (F=7,89; p<0,001). I confronti a rotazione rivelavano che non c’erano differenze significative fra i gruppi nelle 4 settimane iniziali, né alterazioni fra gravità delle cefalee e appartenenza all’uno o all’altro gruppo. I dati sono stati quindi raccolti insieme senza tener conto dei livelli di intensità. Nel gruppo di controllo non c’é stato cambiamento del valore di partenza (129) al primo controllo (120), mentre si é avuto un effetto singificativo sia per il gruppo sperimentale (da 159 a 79). Una strategia alternativa di analisi consisteva nel determinare il successo e l’insuccesso dei trattamenti. Si é presa come definizione di successo una riduzione del 50% dell’indice di cefalea dal valore di partenza al controllo dopo un mese. Nel gruppo sperimentale il tasso di successo (16 su 24 partecipanti) é stato superiore sia al gruppo ambulatoriale (10 su 23), sia al gruppo di controllo (6 su 25). L’analisi del X2 (X2=12,7; 2g1, P<0,01) ha rivelato che si tratta di differenze significative, con un sovrappiù di successi nel gruppo sperimentale di trattamento autosomministrato e un sovrappiù di insuccessi nel gruppo di controllo.
La Tab.3 presenta i dati di una seconda analisi che raffronta gli indici di cefalea dei due gruppi, sperimentale e ambulatoriale, all’inizio e ai tre successivi controlli, a un mese, tre mesi e un anno dalla fine del trattamento. Questa analisi dimostra che in entrambi i gruppi trattati la riduzione si é mantenuta nel tempo.
|
Tempo |
Gruppo ambulatoriale (N=20) |
Gruppo sperimentale (N=21) |
|
|
Inizio |
166 |
153 |
|
|
1 mese |
88 |
72 |
|
|
3 mesi |
85 |
75 |
|
|
1 anno |
71 |
46 |
|
Tab.3 - Indice di cefalea ad inizio sperimentazione e ai controllo a 1 mese, 3 mesi e 1 anno per i gruppi ambulatoriale e sperimentale.
Per esaminare l’efficienza relativa dei diversi trattamenti, abbiamo diviso il numero di minuti di contatto (anche telefonico) terapeuta-paziente per la percentuale di miglioramento registrate al secondo controllo (3 mesi). La Tab.4 mostra che la percentuale di miglioramento per il trattamento autosomministrato e ambulatoriale era quasi uguale - e superiore al gruppo di controllo - ma l’efficienza, misurata come miglioramento per minuto di intervento, era decisamente migliore per il gruppo sperimentale. In questo lavoro l’efficienza é considerata solo dal punto di vista degli operatori, senza tener conto del tempo impiegato dai pazienti o dai genitori nell’esecuzione del programma di terapia.
ANALISI DELL’EFFICIENZA DEI TRATTAMENTI
|
gruppo |
miglioramento medio (%) |
Contatto totale (minuti) |
Miglioramento / minuto di contatto (%) |
Efficienza relativa |
|
Sperimentale |
50.3 |
178 |
0.28 |
7.6 |
|
Ambulatoriale |
47.8 |
485 |
0.098 |
2.7 |
|
Controllo |
5.8 |
157 |
0.037 |
1.0 |
Tab.4 - Analisi dell’efficienza dei trattamenti
Come risulta evidente dalla Tab.5, c’é stato un effetto significativo del tempo sulla depressione (F2=13,61; P<0,001) misurata con la scala di depressione fra i gruppi in nessun momento della sperimentazione.
PUNTEGGI DI DEPRESSIONE
|
gruppo |
iniziale |
Controlli |
||
|
1 mese |
3 mesi |
1 anno |
||
|
Ambulatoriale |
21,4 |
18,2 |
19,1 |
17,7 |
|
Sperimentale |
21,9 |
19,9 |
18,7 |
18,5 |
|
Controllo |
20 |
18,7 |
Tab.5 - Punteggi di depressione
Discussione
Entrambi i metodi di somministrazione del trattamento anti-stress si sono dimostrati efficaci nel ridurre la frequenza e/o intensità delle cefalee, riduzione che si é mantenuta nel controllo a distanza di un anno. Il trattamento autosomministrato é apparso tuttavia più efficiente, almeno dal punto di vista del terapeuta, producendo una percentuale maggiore di miglioramento per unità di tempo impiegato nel trattamento: l’efficienza é stata quasi tripla rispetto al trattamento ambulatoriale. L’efficacia del trattamento autogestito dell’emicrania in età evolutiva corrisponde a quanto accertato da Burke e Coll. (1989) in una sperimentazione.